高效的纯化、检测、固定化或分(fēn)离在现代蛋白研究领域至关重要,特别是在结构基因组學(xué)和蛋白组學(xué)领域。使用(yòng)经济、简单且可(kě)靠的方法快速分(fēn)离重组蛋白(特别是在高通量筛选的实验条件下),有(yǒu)助于快速对其生物(wù)活性进行表征,识别其相互作用(yòng)的物(wù)质。Strep-tag Ⅱ作為(wèi)一种用(yòng)于亲和纯化的短肽标签,与重组蛋白进行融合表达后,可(kě)以进一步用(yòng)于分(fēn)离纯化。
一、Strep-tag发展史
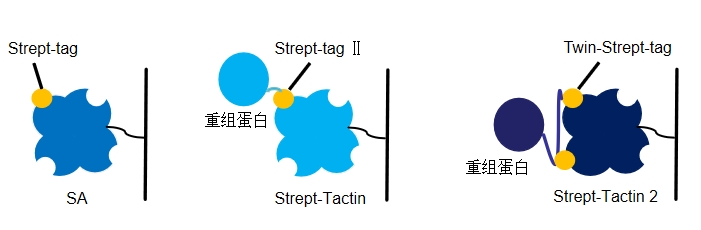
Strep-tag 是从随机文(wén)库中筛选得到的9个氨基酸的短肽( AWRHPQFGG) ,可(kě)与链霉亲和素(SA)进行可(kě)逆结合。当用(yòng)作标签时,可(kě)以与重组蛋白实现融合表达,进而通过SA亲和层析柱一步纯化重组蛋白。Strep-tag 短肽骨架表现為(wèi)螺旋构象( HPQFG) ,其中8个氨基酸残基( WRHPQFGG) 参与亲和作用(yòng),C-末端甘氨酸的游离羧基可(kě)与链霉亲和素R84形成盐桥,因而Strep-tag与蛋白融合表达时被限制在C端。由于SA与Strep-tag的结合位点同其与生物(wù)素的结合位点基本一致,故而Strep-tag可(kě)以与生物(wù)素竞争性的结合SA。
通过将 Strep-tag与目的蛋白融合表达,利用(yòng)填料吸附带有(yǒu)Strep-tag的重组蛋白,再利用(yòng)生物(wù)素竞争洗脱,获得目的蛋白。但由于Strep-tag 仅可(kě)结合在目的蛋白的C端,且其对链霉亲和素的亲和力较弱,因此未得到广泛的应用(yòng)。
在对Strep-tag的氨基酸序列进行优化和修改后,科(kē)研工作者开发了更合适的短肽标签Strep-tag Ⅱ (WSHPQFEK)。Strep-tag Ⅱ是一个由8个氨基酸组成的短肽,其序列為(wèi)Trp-Ser-His-Pro-Gln-Phe-Glu-Lys,不仅可(kě)以结合在蛋白的C端,也可(kě)以结合在蛋白的N端。此外,Strep-tag Ⅱ对蛋白的折叠或生物(wù)活性不产生影响,也不会诱导蛋白聚集,因此后续实验一般无需去除。
在随后的研究工作中,科(kē)研工作者发现如果目标蛋白表达量很(hěn)低,Strep-tag Ⅱ纯化系统不能(néng)快速对蛋白进行纯化,于是对其进一步进行了改造,用(yòng)linker将两个Strep-tag Ⅱ连接在一起,开发出Twin-Strep-tag(也有(yǒu)叫双Strep-tag Ⅱ)。Twin-Strep-tag具有(yǒu)特异性高、一步纯化纯度高、纯化过程条件温和、蛋白两端均可(kě)融合等特点,改善了低浓度样本纯化效果,还能(néng)用(yòng)于捕捉蛋白复合體(tǐ)、检测蛋白间的相互作用(yòng)。
二、 基于Strep-tag的SA改造
最初Strep-tag被开发出来时,其与SA的亲和力相较于生物(wù)素较弱,较弱的亲和力虽可(kě)在相对温和的条件下进行竞争性洗脱,但也限制了其对标签蛋白的捕获,且在较弱的相互作用(yòng)下,不能(néng)保证Strep-tag可(kě)以与配基充分(fēn)结合。因此,需要对SA进行进一步改造,以满足Strept-tag纯化系统的需要。
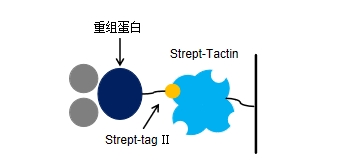
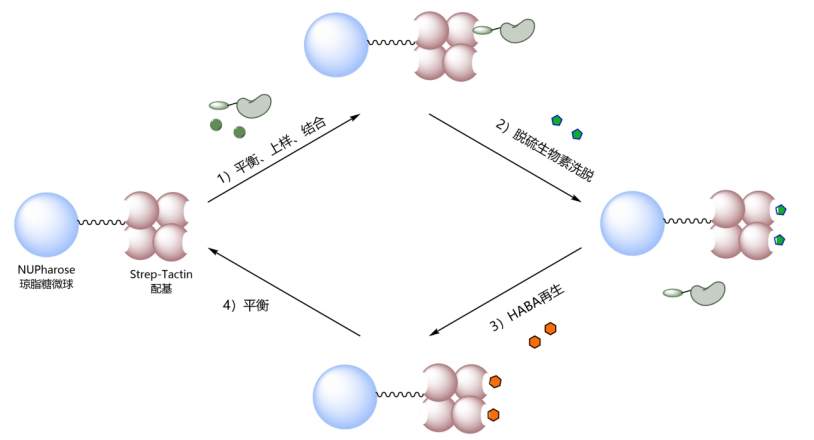
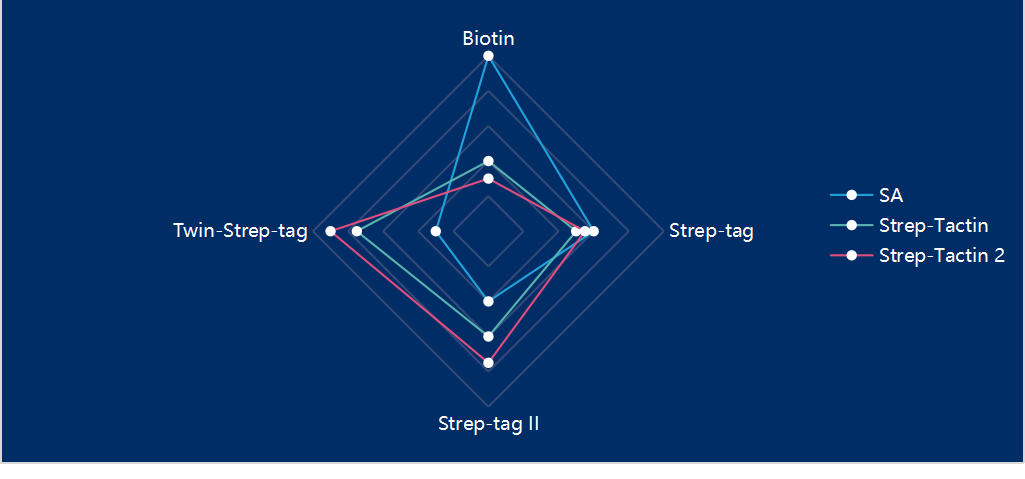
Strep-Tactin是对SA的氨基酸序列进行重构和改造而来的,通过对靠近结合位点的一个环區(qū)中的多(duō)个氨基酸进行突变,从而获得有(yǒu)活性且与Strep-tag Ⅱ亲和能(néng)力增强的SA突变體(tǐ),即Strep-Tactin。相较于SA,Strep-Tactin 与 Strep-tag Ⅱ 的结合更加紧密,能(néng)够在温和的条件下与Strep-tag Ⅱ融合蛋白进行结合和解离。而且由于Strep-Tacin对Strep-tag Ⅱ具有(yǒu)高度特异性,一般一步纯化就能(néng)获得高纯度的蛋白样品(图1),被广泛应用(yòng)于蛋白纯化或检测中,以及某些细胞分(fēn)离检测领域。一般选用(yòng)脱硫生物(wù)素进行竞争性洗脱即可(kě),利用(yòng)2-(4-羟基苯唑)苯甲酸(HABA)溶液可(kě)实现Strep -Tactin填料的再生。
但是,Strep-Tactin也有(yǒu)一定的局限之处,比如,在变性条件下并不稳定,无法进行纯化,且进行批量纯化时,即使搭配Twin-Strep-tag,效果仍不尽人意。因此对Strep-Tactin进行进一步改造后,得到与Twin-Strep-tag亲和力更高的Strep-tactin2。同时,因亲和力增加,即使经过多(duō)次清洗步骤,目的蛋白也不会从Strep-Tactin2上解离,从而提高了目标蛋白的得率。2018年,中南大學(xué)湘雅二医院的科(kē)研工作者通过将 Strep-tag Ⅱ融合在目标蛋白的C端,利用(yòng)这一亲和纯化系统,首次从哺乳动物(wù)细胞中分(fēn)离纯化得到了TMEM8B-a蛋白,并验证该蛋白在抑制肿瘤细胞侵袭转移中发挥重要作用(yòng)。
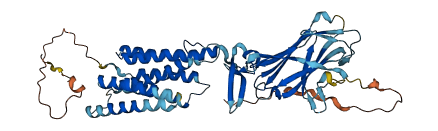
TMEM8B-a蛋白的三级结构图
Strep-tag系统的发展过程由Strep-tag到Strep-tag Ⅱ再到Twin-Strep-Tag,其与SA的亲和力和特异性逐渐增强,与之相关的亲和纯化填料由Strep-Tactin 到改造后的Strep-Tactin 2 ,其与Strep-tag系列短肽标签的亲和力也逐渐增强。
纽龙生物(wù)通过自有(yǒu)的蛋白定向进化及发酵生产平台,对SA进行了一系列改造及优化,具有(yǒu)多(duō)达数十种SA突变體(tǐ)的蛋白文(wén)库。基于自有(yǒu)填料研发平台,利用(yòng)重组Strep-Tactin 2开发出用(yòng)于Strep-tag纯化系统的亲和纯化填料。
Strep-Tactin 2 NUPharose FF(NRPB61L)在用(yòng)于纯化带Strep-tag Ⅱ 和Twin-Strep-tag 的重组蛋白时,具有(yǒu)如下优势:
高选择性:Strep-Tactin 2 对标签的选择性大大提高,无论是Strep-tag Ⅱ 还是Twin-Strep-tag,都能(néng)够实现较好的纯化效果,一般只需一步纯化就能(néng)获得高纯度的蛋白质样品。
高结合载量:通过对配基设计进行改进,进一步提高了对标签的亲和力,并且削弱了与生物(wù)素的亲和力,从而能(néng)够更牢固的结合重组蛋白,动态结合载量可(kě)以达到10 mg/mL。
高耐受性:通过对配基、偶联、填料的优化改造,提升了对某些蛋白变性剂、表面活性剂的耐受性。
经济性:在洗脱方面,可(kě)以使用(yòng)生物(wù)素进行洗脱,相对昂贵的脱硫生物(wù)素更经济。
[1] Skerra A,Schmidt TG.Use of the Strep-Tag and streptavidin fordetection and purification of recombinant proteins[J].Methods Enzymol,2000,326: 271-304
[2] Schmidt, Thomas G. M. , et al. "Molecular interaction between the Strep-tag affinity peptide and its cognate target, streptavidin. " Journal of Molecular Biology 255.5(1996):753-766.
[3] Wang L,Fan M,Zeng C,et al. Expression and purification of a rapidly degraded protein,TMEM8B-a,in mammalian cell line[J]. Protein Expr Purif,2018,151: 38-45
[4] 张檬,罗棉兴,陈國(guó).链霉亲和素及其亲和系统的蛋白质进化[J].中國(guó)生物(wù)化學(xué)与分(fēn)子生物(wù)學(xué)报, 2019, 35(7):8.DOI:CNKI:SUN:SWHZ.0.2019-07-004.