重组蛋白是应用(yòng)基因重组克隆技术从而获得的蛋白质。基因重组技术先应用(yòng)基因克隆或化學(xué)合成技术获得目的基因,再连接到适合的表达载體(tǐ),导入到特定的宿主细胞,利用(yòng)宿主细胞的遗传系统,最终表达出具有(yǒu)特定功能(néng)的蛋白质。
重组蛋白表达技术已经广泛应用(yòng)于生物(wù)學(xué)的各个领域,目前,體(tǐ)外重组蛋白表达系统主要有(yǒu)以下几类:原核表达系统、真核表达系统、昆虫细胞表达系统、哺乳动物(wù)细胞表达系统。一般的实验过程包括载體(tǐ)构建-表达鉴定-蛋白纯化等等。
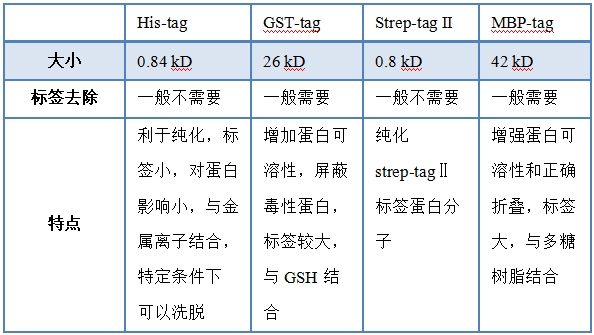
其中,蛋白纯化的目的是将目标蛋白从实验样本中分(fēn)离出来,同时仍保留目的蛋白的理(lǐ)化特性及生物(wù)學(xué)功能(néng)。在蛋白纯化的过程中,合适的标签不但有(yǒu)利于蛋白的纯化,同时也可(kě)能(néng)对蛋白的可(kě)溶性和稳定性有(yǒu)一定帮助。利用(yòng)基因重组技术,将蛋白标签与目的蛋白一起融合表达并用(yòng)于下一步纯化。目前较為(wèi)常用(yòng)的蛋白标签主要有(yǒu):His-tag、GST-tag、MBP-tag、Strep-tag II、SUMO-tag、HA-tag等,部分(fēn)功能(néng)和特点如下表所示。
一、His-tag
His-tag由多(duō)个组氨酸残基(一般為(wèi)6个)组成,可(kě)插入在目的蛋白的C末端或N末端,标签本身的特性对目的蛋白影响很(hěn)小(xiǎo),免疫原性相对较低,纯化的蛋白直接用(yòng)于抗體(tǐ)制备,是目前最常用(yòng)的表达纯化标签。
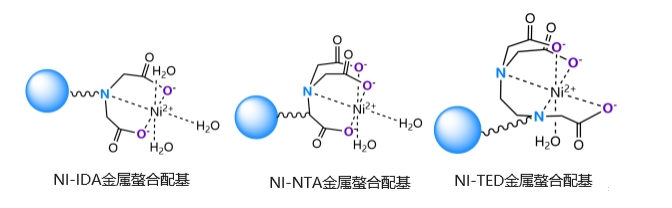
His-tag可(kě)以与Ni2+、Co2+等过渡金属离子形成配位键,与金属离子选择性结合,从而可(kě)以将金属离子固定在磁珠或树脂上,对蛋白进行纯化。其中,Ni2+是亲和纯化实验中使用(yòng)最多(duō)的金属离子,Ni2+在琼脂糖上的螯合形式多(duō)样,不同的螯合结构决定了Ni2+在层析介质上的稳定性和结合能(néng)力差异,目前市面上His-tag蛋白纯化介质比较常用(yòng)的配基是IDA、NTA和TED。
使用(yòng)方法简述:
1、平衡和上样:用(yòng)平衡缓冲液平衡层析柱,进行上样。
2、洗杂:在缓冲液中添加低浓度的咪唑(譬如5~50mM)冲洗层析柱。
3、洗脱:用(yòng)合适浓度的咪唑缓冲液进行洗脱(建议用(yòng)50~500mM的線(xiàn)性梯度)。
4、再生:建议选择加有(yǒu)200 mM EDTA+500 mM NaCl的缓冲液将Ni2+金属离子剥离。
5、在位清洗(CIP):通常上述的再生过程可(kě)将填料彻底清洗。
6、填料保存:填料的初始保存液為(wèi)20%乙醇,使用(yòng)过后可(kě)继续用(yòng)20%乙醇保存。保存温度在4~30 ℃為(wèi)宜,不可(kě)冻存。
二、GST-tag
1988年,Smith和Johnson首次提出谷胱甘肽S-转移酶(GST)亲和标签的概念,GST是由多(duō)基因编码、具有(yǒu)多(duō)种功能(néng)的超家族酶,广泛存在于细菌、真菌、动物(wù)和植物(wù)體(tǐ)内,其专一性催化还原型的谷胱甘肽巯基与其他(tā)化合物(wù)的亲電(diàn)基团,生成谷胱甘肽衍生物(wù)。在生物(wù)研究领域,来源于日本血吸虫的GST,是目前应用(yòng)最為(wèi)广泛的融合标签之一。基于酶和底物(wù)的作用(yòng)原理(lǐ),利用(yòng)谷胱甘肽(GSH)结构和GST结合位点互补的特点,将谷胱甘肽SH基团与琼脂糖介质上的预活化基团偶联,形成特异性的亲和填料。带有(yǒu)GST标签的目标蛋白与琼脂糖介质上交联的GSH配基发生结合。这种结合具有(yǒu)可(kě)逆性,可(kě)以在温和、非变性的条件下通过在缓冲液中加入还原型GSH洗脱下来,杂质在结合过程中流穿或被洗脱去除,实现目的蛋白的分(fēn)离。
GST-tag作為(wèi)标签蛋白应用(yòng)到重组蛋白的纯化过程中,可(kě)插入在目的蛋白的C末端或N末端。一般选择GST-tag可(kě)以提高蛋白表达的可(kě)溶性,也可(kě)以一定程度上提高蛋白的表达量。蛋白表达纯化结束后需根据不同的下游应用(yòng)而确定是否切除标签。GST-tag洗脱条件温和,但跟His-tag相比,分(fēn)子量较大,可(kě)能(néng)会影响蛋白的功能(néng)和下游实验的应用(yòng)。另外,如果蛋白以不可(kě)溶的方式表达出来,很(hěn)难用(yòng)变性复性的方法进行纯化。
使用(yòng)方法简述:
1、平衡和上样:用(yòng)平衡缓冲液平衡层析柱,进行上样。
2、洗脱:用(yòng)合适浓度(建议10 mM)的还原型谷胱甘肽溶液进行洗脱。
3、再生:先用(yòng)蒸馏水冲洗,接着用(yòng)平衡液冲洗至平衡。
4、在位清洗(CIP):可(kě)用(yòng)盐酸胍也可(kě)用(yòng)70%乙醇清洗。
5、填料保存:填料的初始保存液為(wèi)20%乙醇,使用(yòng)过后可(kě)继续用(yòng)20%乙醇保存。保存温度在4~30 ℃為(wèi)宜,不可(kě)冻存。
三、MBP-tag
MBP即麦芽糖结合蛋白,由大肠杆菌K12的malE基因编码,是细菌麦芽糖转运系统的成员之一,能(néng)结合微摩尔水平的麦芽糖和麦芽糊精。1988年,MBP亲和标签首次应用(yòng)于大肠杆菌重组蛋白的表达纯化,值得一提的是,MBP的折叠过程需要DnaK-DnaJ-GrpE和GroEL-GeoES两个分(fēn)子伴侣系统的帮助,当进行MBP融合蛋白的重组表达时,这些分(fēn)子伴侣也会聚集在目标蛋白的附近,帮助它们正确折叠,并增加目标蛋白的可(kě)溶性。
MBP是蛋白质纯化最常用(yòng)的大标签,分(fēn)子量约42 kD,MBP可(kě)以和糊精亲和树脂结合,可(kě)用(yòng)10-20 mM麦芽糖在温和条件下洗脱,得到高纯度、高浓度目标蛋白,达到快速、高效的捕获与纯化目的。若需要除去MBP-tag,可(kě)用(yòng)位点特异性蛋白酶切除。
使用(yòng)方法简述:
1、平衡和上样:用(yòng)平衡缓冲液平衡层析柱,进行上样。
2、洗脱:一般推荐用(yòng)10mM麦芽糖溶液进行洗脱。
3、再生:先用(yòng)蒸馏水清洗,然后用(yòng)0.5M NaOH再生。
4、填料保存:填料的初始保存液為(wèi)20%乙醇,使用(yòng)过后可(kě)继续用(yòng)20%乙醇保存。保存温度在4~30 ℃為(wèi)宜,不可(kě)冻存。
四、Strep-tag II
Strep-tag是基于生物(wù)素和链霉亲和素之间的相互作用(yòng)而开发出来的。Strep-tag分(fēn)子量较小(xiǎo),仅有(yǒu)0.8kD,对融合后蛋白质结构和功能(néng)的影响可(kě)以忽略不计,通常无需切除。早期开发的第一代Strep-tag仅可(kě)以接在蛋白的C端,对实际应用(yòng)产生了一定的限制,故而研究者在Strep-tag的基础上,进一步开发了Strep-tag II,可(kě)以结合在蛋白质的N端和C端。不过随着对标签的特异性以及亲和力的要求进一步提升,研究者进一步进行了改造,通过将两个Strep-tag以linker连接在一起,开发出Twin Strep-tag,再度提升了目标蛋白与Strep-Tactin的结合强度,改善了低浓度样本纯化效果,还能(néng)用(yòng)于捕捉蛋白复合體(tǐ)、检测蛋白间的相互作用(yòng)。Strep-tag 具有(yǒu)特异性高、单步纯化纯度高、过程条件温和、蛋白两端均可(kě)融合等特点。
同时相应地,作為(wèi)纯化配基的链霉亲和素,為(wèi)了增强和标签的亲和能(néng)力,以及降低洗脱的难度,研究者也进行了一系列的改造。纽龙生物(wù)研发团队通过分(fēn)子克隆蛋白重组等技术,对链霉亲和素进行改造,开发出Strep-tactin和Strep-tactin2做為(wèi)纯化填料的配基,具有(yǒu)更高的亲和力,可(kě)以按照不同应用(yòng)场景选用(yòng)不同的物(wù)质进行洗脱和再生,满足不同的需求。
使用(yòng)方法简述:
1、平衡和上样:用(yòng)平衡缓冲液平衡层析柱,进行上样。
2、洗脱:用(yòng)合适浓度的缓冲液(脱硫生物(wù)素或生物(wù)素)进行洗脱。
3、再生:用(yòng)0.5M NaOH或者合适浓度的HABA缓冲液再生。
4、填料保存:填料的初始保存液為(wèi)20%乙醇,使用(yòng)过后可(kě)继续用(yòng)20%乙醇保存。保存温度在4~30 ℃為(wèi)宜,不可(kě)冻存。
随着研究需求的增多(duō)和生物(wù)技术的发展,各种标签应运而生,多(duō)样化的标签蛋白可(kě)以满足不同的实验目的,除了本文(wén)提到的标签外,还有(yǒu)Myc、HA、SUMO等,如您有(yǒu)新(xīn)的标签蛋白以及纯化填料需求,纽龙生物(wù)愿以开放的态度,与您携手,共同开发。
五、纽龙产品介绍
杭州纽龙生物(wù)科(kē)技有(yǒu)限公司是一家专注于重组蛋白以及蛋白纯化填料研发生产的國(guó)家高新(xīn)技术企业。基于自有(yǒu)技术平台,实现填料与配基的双重突破,开发出一系列可(kě)用(yòng)于不同标签蛋白的纯化填料,如Ni-IDA NUPharose FF、GST NUPharose FF、Strep-Tactin NUPharose FF、Dextrin NUPharose FF等,性能(néng)可(kě)比可(kě)靠,批间差小(xiǎo),供货持续稳定,此外,我们提供不螯合金属离子的纯化填料,可(kě)以满足客户在重组蛋白纯化领域的不同需求,如有(yǒu)需要,欢迎拨打0571-82872376联系我们。
参考文(wén)献:
[1]Pina, Ana & Batalha, Íris & Roque, Ana. (2014). Affinity Tags in Protein Purification and Peptide Enrichment: An Overview. 10.1007/978-1-62703-977-2_14.
[2]Kimple ME, Brill AL, Pasker RL. Overview of affinity tags for protein purification. Curr Protoc Protein Sci. 2013 Sep 24;73:9.9.1-9.9.23. doi: 10.1002/0471140864.ps0909s73. PMID: 24510596; PMCID: PMC4527311.
[3]Mishra V. Affinity Tags for Protein Purification. Curr Protein Pept Sci. 2020;21(8):821-830. doi: 10.2174/1389203721666200606220109. PMID: 32504500.